外源DNA导入植物技术,是将带有目的性状基因的供体总DNA片段导入目的植物,筛选获得目的性状的后代,培育新品种,属远缘杂交。应用该技术,不需要原生殖体或细胞等离体组织培养和诱导再生植株,易于育种工作者掌握和实践,可以在常规育种的基础上发展分子育种。该技术食品经检测系非转基因食品,安全可靠,能够大大降低劳动力成本。可使目的植物达到高产、优质、多功能性等特征!
外源DNA直接导入植物技术的设想,是中国科学院上海生物化学研究所周光宇教授1974年在我国率先提出来的,何登骥被这个全新的技术科学原理和科学概念所吸引,立即答应与周光宇合作。

1996年省科委将水稻研究所主持的,外源DNA导入技术培育水稻新品种列入“九五”攻关课题。何登骥老师参与了水稻花粉管通道育种技术研究。在实际操作中,他发现该技术在低世代,优势特征不明显,可控性差等问题。为找出一套行之有效的解决方法,一是查阅资料作读书笔记,二是积极探索增加动手能力。
这种技术不仅具有不改变传统水稻固有的遗传性状,同时把水稻品种有益的隐形性状转为显性。经过20余年的进一步探索,准确掌握了一套新型花粉管通道分子育种技术。这套生物育种技术,在他的研究所使水稻育种变得更快捷、稳定,可控性强,安全、实用性更广泛。
目前已经育成一批带有目的性状的优质高产水稻、耐盐水稻、含低隔水稻新品系、香型水稻品系、富硒水稻品系、旱稻品系等水稻品种和稻种资源。选育出的水稻新品种(系)在长相、产量、品质、功能、抗性、适应性等方面比原来传统水稻有很大程度的提高和发展。


如我们看到的大穗苦瓜早稻517(功能性1号):于2008年6月提取食用苦瓜外源总体DNA导入受体水稻新品系8早8112【P47(早稻85-183+玉米)+湘早籼27号】,经2009年至2013年每年在湖南长沙东郊和海南三亚种植选育,于2014年稳定,2015年作早稻新品系观察,2016年进入早稻品比试验,两次重复,全生育期118天。平均亩产1362.5斤。比对照早优604(亩产875.4斤),增产35.8%。
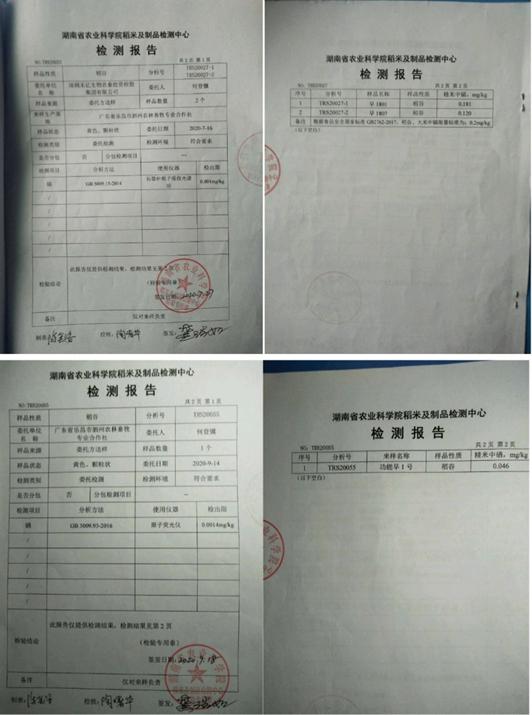
经湖南省农科院稻米及制品检测中心化验分析结果:糙米率79.72%,精米率75.36%,整精米率61.07%,里白度乳白米长6.45毫米,长宽比3,直链淀粉0.91%,胶稠度105米,糊化浓度2级,蛋白质含量9.68%。隔含量为0.12mg/kg,属低隔水稻品种!该品系茎杆粗壮,叶片挺直,耐肥抗倒,特大穗,高结实,每亩有效穗15.2万,每穗总粒数350—650粒,结实率95%。表现突出,2017年已获农业部保护。

无极道控股集团赵红梅由韶关市发展研究中心,仁化县政府办、农机局领导陪同考察!
我们陪何登骥老师前几年与无极道集团合作在仁化县的种植中感悟,一切新品种和新农艺都不是突如其来,自我发育和自我生长起来的,而是来自最纯粹的科学领域持续不懈的艰难探索得来的。可喜的是,在何登骥老师的不懈努力指导下,种植的优质稻种,即将为健康产业形成订单农业,对社会的贡献也在产生积极影响。


据悉,从2020年春与广东省乐昌市泗洲农林畜牧专业合作社签订了合作开发双季种植试验协议。在今年规模种植的“功能早生1”水稻据湖南省农业科学院稻米及制品检测分析室分析结果为:(1)出糙率为81.5%,(2)整糙米率61.6%、(3)晋白粒率4.5%、(4)晋白率0.3%、(5)长宽比3.6,五项指标全部符合“优质稻谷”一等标准。
现已83岁高龄的何登骥老师成功地把其他农作物、植物DNA导入水稻,培育出一个个新型品种(系)。培养出来的新品种不仅在提高米质上取得骄人成绩,而且在人们食用后发挥出保健作用。这些稻米,有的可以增钙,有的可以补硒,有的可以降糖,有的可以养颜,有的可抗癌,增强免疫力;还有一种特殊成份叫“生物警察”,专抓体内致癌基因—自由基。人们食用了这些稻米,就象给自己身体注入了“长寿基因”、 “健康基因”、“美丽基因”。任何收获不是巧合,这些优质大米即将走进平常百姓家;而是每天的努力与坚持得来的。
为实现花粉管道法将外源DNA导入水稻的育种目标,在逐梦的实践路上,一步一个脚印,持续不懈的艰苦探索,熟练掌握了一系列花粉管通道法的育种技术为实现花粉管通道法水稻育种技术产业的成果付出的坚辛劳动,就像一个大国工匠,逐圆农科梦!

“中国最美县域——乐昌”直播团队助力“2017中国最美古村落”农特产品的销售。图为直播团队调研乐昌时到廊田镇楼下古村考察,该村党总支部书记邓泗洲(中)与CCTV17“最美县域”展播团队成员合影。
乐昌市廊田镇楼下村位于乐昌市东部,廊田镇最南部,总面积约20平方公里,有“粤北粮仓”之称、距离乐昌市政府11公里,距离廊田镇政府4公里。楼下村下辖楼下、圩坪、鹿江等3个自然村, 村居民人口 4276人、总户数1016户,楼下村是一个近1500年历史的古村落,历史上曾经出过多名进士县令以上官员,历史文化底蕴深厚,2017年曾被文博会评为“中国最美古村落”!主要种植水稻、蔬菜、马蹄、香芋等农作物,共有耕地面积4426亩。

附件:论文被湖南农业大学学报录用,2021.1见刊。
还花粉管导入苦瓜DNA籼稻的全基因组重测序及精米营养品质分析
袁洁1 何登骥2 何加太2 詹庆才3周昆2 何艳1阳永建1 魏颖娟4 陶湘林4 唐汉军1,4*
(湖南大学研究生院隆平分院1,长沙410125)
(湖南省农业科学院水稻研究所2,长沙410125)
(湖南省农业科学院生物技术研究所3,长沙410125)
(湖南省农业科学院农产品加工研究所4,长沙410125)
摘要本研究针对花粉管通道法导入苦瓜DNA的籼稻子代D9和受体RT,采用Illumina HiSeqTM平台进行了全基因组重测序,并分析了精米的基本营养成分、总皂苷成分以及膨胀势和米饭的食味品质。结果表明,苦瓜的部分DNA片断被整合进了受体水稻的DNA中,并在预期的皂苷成分含量上阳性表达,苦瓜基因对水稻的营养成分生成有改善作用,对食味口感有负面作用。
关键词苦瓜DNA 花粉管通道法籼稻碱基序列营养品质
WGS and white rice nutrition quality analysis of the bitter melon DNA of
the pollen tube imported indica rice
Yuan Jie1 He Dengji2 He Jiatai2 Zhan Qingcai3 Zhou Kun2 He Yan1 Yang Yongjian1
Wei Yingjuan4 Tao Xianglin4 Tang Hanjun1,4*
(Longping Branch, Graduate School of Hunan University1, Changsha410125)
(Rice Research Institute of Hunan Agricultural Sciences Academy2,Changsha 410125)
(Biotechnology research institute of Hunan Agricultural Sciences Academy2,Changsha 410125)
(Agricultural Products Processing Institute of Hunan Agricultural Sciences Academy3,
Changsha410125)
AbstractOffspringD9from Indica riceimported bitter melon DNA by pollen tube channelmethod and the receptor (RT), and the whole genome was sequenced by Illumina HiSeqTMin this research. At the same time, the nutritional composition contents and total saponin content in milled rice, and the swelling power and the edible quality of milledrice were analyzed. The results indicated that parts of the melon’s DNA fragmentwere integrated into the rice’s DNA and the positive expression on expected saponin content. The bitter melon gene have improvementon the nutrientsand a negative effect on taste in rice.
Key words Bitter melon DNA, Pollen tube channelmethod, Indica rice, Base sequence, Nutritional quality
1、前言:
花粉管通道法是周光宇等[1]于上世纪80年代创立的一种远缘DNA片段杂交的分子育种技术。数十年来,基于该技术我国科学家相继在玉米[2-6]、小麦[7-11]、水稻[12-13]、棉
花[14]、芝麻[15]、胡麻[16]、杨树[17]等粮食、经济作物和林业领域创制出大量的新品种、新品系和育种资源,为我国农业和经济发展作出了巨大的贡献。这些研究成果主要以改进作物农艺性状和提高产量为目的。但隋着社会经济的发展,生活节奏加快、工作压力加大,亚健康人群激增,人们的健康意识普遍增强。在此大背景下,普通食品功能化和功能食品主食化成为大健康产业发展的一个重要趋势[18]。近年高蛋白质、高赖氨酸、低谷蛋白质、调节高血压、富铁、富硒、富锌 抗过敏、高半胱氨酸、功能肽、花青素、巨胚等,以强化或降低稻米原有的某个成分的功能稻新品种相继问世[19-20],但以导入远缘物种活性物质为目的的水稻品种还少见。
苦瓜是一种富含多糖、生物碱和苷类等活性化合物的常见蔬菜,具有降血糖[21-27]、防止骨质疏松[28]、抗氧化防衰老[29-30]、预防脂肪肝[31]和抗癌[32]等作用。本团队应用花粉管通道法将苦瓜DNA导入籼稻,经过多年的筛选,获得了农艺性状较好、遗传稳定的子代。本研究主要目的是验证农艺性状优良的子代DNA中是否融合进了预期的苦瓜活性成分相关的基因片段,并在营养品质上能够阳性表达。
2、试验材料与方法
2.1材料
试验材料:苦瓜DNA导入水稻子代第9代稻谷(试验编号D9、2018年、湖南)和受体籼稻稻谷(试验编号RT、2018年、湖南)为湖南省水稻研究所何登骥研究员提供。
主要试剂:Tris、HC1、蔗糖、琼脂糖、人参皂苷标准物质、香草醛、醋酸酐、乙醇、硫酸等及其它试剂均采用优级纯或分析纯。
2.2主要仪器
SCIENTZ-950E超声波细胞破碎仪(宁波新芝)、Centrifuge 5418 R 冷冻离心机(德国), PF-20R高速冷冻离心机(湖南平凡)、Sup-756紫外分光光度计(上海光谱)、Illumina HiSeqTM测序仪(美国)、JB-10磁力搅拌器(常州澳华)、BF51894JC-1马弗炉(美国)、GFL-70鼓风干燥箱(天津莱伯特)、XJS20石墨消解仪(天津莱伯特)、STA1B米饭食味仪(日本佐竹)。
2.3方法
2.3.1 总DNA提取与检测
稻谷通过实验室盆栽育苗,大约生长到20cm左右,取幼苗叶片组织适量,参照闫双勇等的方法[33]提取叶片全DNA。DNA纯度采用NanoDrop2000 方法检测,DNA浓度采用Picogreen方法检测,DNA完整性采用琼脂糖凝胶电泳方法检测。
2.3.2 DNA全基因测序
测序委托上海美吉生物医药科技有限公司实施。样品基因组DNA检测合格后,利用超声波将DNA序列片段化形成随机片段,对片段化的DNA依次进行末端修复,3′端加A连接测序接头后,再利用磁珠吸附富集基因组长度为400 bp左右的片段,经过PCR扩增形成测序文库。建好的文库先进行文库质检,质检合格的文库用Illumina HiSeqTM平台进行测序,测序策略为Illumina PE150,总测序读长为300 bp。Illumina测序错误率见表1.
在Illumina HiSeqTM平台测序的原始数据下机后,采用Fastp应用软件(0.19.6版)对下机数据进行质量控制,过滤其中低质量的数据,具体处理见表2。对获得的高质量数据,利用 BWA 应用软件(0.7.17版)将高质量数据比对到参考基因组序列上,获得序列的位置归属(即BAM 文件)。
表1 Illumina HiSeqTM的测序错误率
碱基质量值(Q)
错误率(%)
13
20
30
40
5
1
0.1
0.01
表2原始数据过滤处理
Step 1:去除读段中的接头序列;
Step 2:剪切掉5’端测序质量值低于20 或识别为N(无法判断)的碱基;
Step 3:剪切掉3’端测序质量值低于3 或识别为N 的碱基;
Step 4:以4个碱基为窗口,剪切掉平均质量值小于 20 的窗口中的碱基;
Step 5:去除含N的比例达到10%的读段;
Step 6:剪切掉超过40%的碱基质量值低于15的读段;
Step 7:舍弃掉去除接头序列及质量修剪后长度小于30 bp的读段。
2.3.3 苦瓜基因序列鉴定
将D9样本的测序序列与苦瓜基因组比对,保留完全比对上的序列,再将保留的
序列与RT样本序列比对,去除和RT对上的读段,获取苦瓜独有的基因序列。比对用苦瓜基因组数据来源于https://www.ncbi.nlm.nih.gov/genome/?term=Momordica+charantia。
2.3.4 精米的基本营养成分含量分析
将精米粉碎成100目的粉体备用,采用AOAC法[34]分析基本营养成分,糖分(%)=100-粗蛋白-粗脂肪-膳食纤维-灰分。
2.3.5 精米的总皂苷含量分析
准确称取精米粉5 g,加入80%乙醇溶液75 mL, 于90 ℃回流提取1 h, 重复2次, 合并提取液定容后作为分析样品, 以人参皂苷为标准样品,参照张中伟等的比色法测定含量[35]。
2.3.6膨胀势的测量
采用Tang等[36]的方法,准确称取精米粉1 g,加水20 mL,制取糊化胶体后,分析重量。膨胀势(g/g)=糊化胶体重/精米粉重。
2.3.7米饭质构和食味分析
参照赵春芳等的方法[37]采用日本佐竹食味仪分析。
2.3.8数据统计分析
所有试验数据均采用Excel2016和SPSS7.0软件进行统计分析。
结果与分析
3.1 谷粒和糙米形态
苦瓜DNA导入水稻的子代(D9)和受体水稻(RT)的谷粒及糙米的形态、大小和颜色在目测下没有明显的差异(图1)。

图1 水稻籽粒的形态。上行为RT的谷粒和糙米;下行为D9的谷粒和糙米。
3.2 苦瓜基因序列鉴定
以实验室盆栽培育的幼苗叶片组织作为总DNA的提取材料,最终获得了RT的总DNA4.0 μg,D9的DNA2.9 μg,经过纯度检测OD值均大于1.8,总量满足两次标准建库需求
(表3),并进一步通过凝胶电泳检测,如图2所示得到了单一条带图谱,说明DNA样品完整,满足测序要求。
表3 水稻幼叶总DNA的浓度和纯度
样品
浓度(ng/μL)
总量(μg)
OD260/280
OD260/230
RT
40.0
4.0
1.86
1.95
D9
29.0
2.9
1.96
2.26

图2 水稻叶片总DNA的凝胶电泳检测。
上述样品基因组DNA检测合格后,采用超声波将DNA序列片段化,对片段化的DNA依次进行末端修复,3′端连接测序接头后,再利用磁珠吸附富集基因组长度为 400 bp 左右的片段,经过PCR 扩增形成测序文库。建好的文库质检合格后,采用Illumina HiSeqTM平台进行测序,测序策略为Illumina PE150,总测序读长为300 bp。通过对碱基含量分布和错误率分布统计分析合格后,进行测序数据过滤处理,获得的高质量读段结果如表4所示。RT和D9的高质量读段数分别为57565143和54414968,总碱基数分别为17343050961和16394835413,GC含量分别为43.13%he 43.06%,修剪接头后质量值大于或等于30碱基片断(Q30)占总读段的比例分别达到93.19%和92.92%。
表4 水稻幼叶DNA片段测序数据过滤结果
样品
高质量读段数
总碱基数
GC (%)
Q30 (%)
RT
57565143
17343050961
43.13
93.19
D9
54414968
16394835413
43.06
92.92
将D9样本的高质量读段测序序列与苦瓜基因组比对,完全比对上的序列保留,再将保留序列与RT样本序列进行比对,去除和RT对上的读段,最终获得了表5所示的11条苦瓜特有的基因序列。这些结果表明,通过花粉管导入法苦瓜的部分DNA片断被整合进了水稻的DNA中,并能稳定遗传给子代,形成了新的水稻品种。
表5 D9幼叶DNA中的苦瓜独有碱基序列
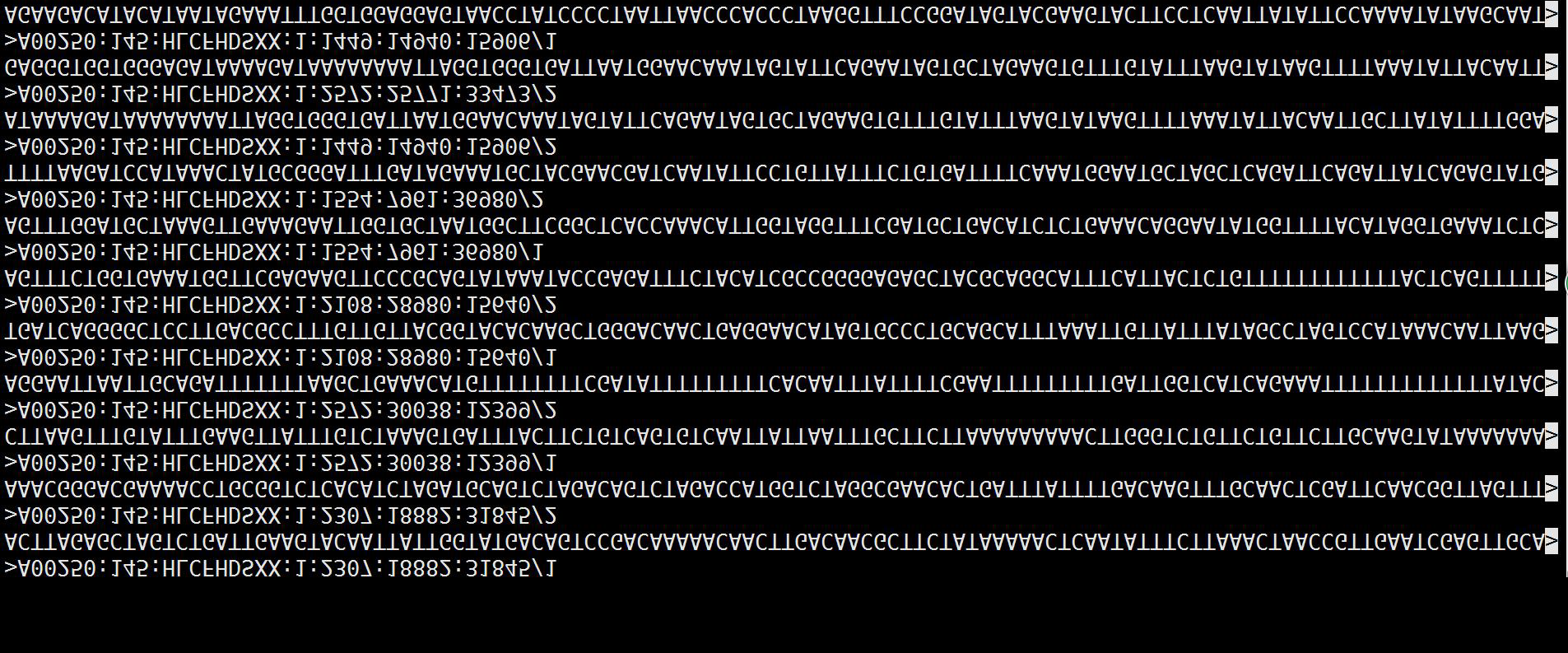
注:“>”开头的是读段的名称(标识符)。
3.3 精米的基本营养成分分析
精米的基本营养成分如表6所示。总体上各成分含量与前报道的籼稻米数据类似[38-39]。蛋白质和糖分的含量D9和RT之间没有变化,D9脂肪含量有意减少,膳食纤维和灰分含量有意增加。从现代大健康产业和消费者志向的角度考察,苦瓜基因的导入对精米的营养成分组成有改善作用。
表6 精米的基本营养成分(干基)
样品
粗蛋白%
粗脂肪%
糖分%
膳食纤维%
灰分%
RT
D9
5.06±0.01a
5.04±0.00a
2.68±0.21b
3.58±0.36a
88.57a
88.62a
0.78±0.04b
0.67±0.01a
2.50±0.28b
2.01±0.01a
注:同列不同英文字母表示显著差异(p<0.05),n=3。
3.4 精米的总皂苷含量分析
苦瓜的主要活性成分是皂苷类化合物[21-32],针对精米的乙醇提取物采用醋酸酐-硫酸法和香草醛-硫酸法进行了总皂苷显色分析(图3)。两种方法D9均发生了与前报道[35]相同的显色反应,以人参皂苷为标准物质定量分析的结果,RT为108.2 mg/100g,D9为605.1 mg/100g,D9显著高与RT,达5倍以上。因分析样品是粗提取物,蛋白质、糖类、黄酮类、甾体类、其它生物碱等成分也可能有显色,一般分析值偏高[35],RT的值也许是非皂苷类的贡献[39]。为获得更准确的数据,有待进一步提高分析样品纯度进行分析,但基本上可以判断苦瓜功能成分的相关基因在水稻籽粒中有阳性表达,达成了预期的育种目标,可以期待该品种在高血糖等亚健康人群的健康饮食上发挥积极作用。

图3 总皂苷的比色分析。a和b为RT的乙醇提取物;c和d为D9的乙醇提取物。上图为醋酸酐-硫酸法;下图为香草醛-硫酸法。
3.5 精米及米饭的物理特性和食味分析
表7表示精米及米饭的物理特性和食味分析结果。精米粉完全糊化后的膨胀势,RT为15.5g/g,D9为14.8g/g,略低于RT,与前报道的籼稻米膨胀势类似[38]。米饭质构的3个指标,D9的硬度高于RT,黏度和弹性没有差异。食味评价各指标值,D9均低于RT,但与前报道的“南粳5055”和“美东194”等粳稻食味评价值类似[37],说明D9在食味品质上虽比RT有所降低,但依然达到了优质米的级别。这些结果表明苦瓜基因对受体的淀粉合成基因表达可能有不良干扰,其影响和机理有待今后进一步研究。
表7 精米及米饭的物理特性和食味评价
指标
RT
D9
膨胀势(g/g)
15.5±0.6
14.8±0.2
硬度(g)
1.6±0.3a
2.5±0.3b
黏度(g)
0.1±0.0
0.1±0.0
弹性(g)
0.9±0.0
0.9±0.0
外观值
6.7a
6.0b
口感值
6.8a
6.1b
综合值
77.4a
71.8b
注:同行不同英文字母表示显著差异(p<0.05),n=6。
结论
通过花粉管导入法苦瓜DNA的部分片段融合进了籼稻DNA中,并获得了稳定遗传的子代;
融合进籼稻DNA中的苦瓜基因片段中包含有预期的苦瓜活性成分相关基因,并能够阳性表达,达成预期的育种目标;
融入到籼稻DNA结构的苦瓜基因对水稻的营养成分生成有改善作用,但对食味口感有负面影响,其作用机理有待进一步研究。
参考文献
[1]周光宇、翁坚、龚纂纂、等,农业分子育种一授粉后外源DNA导入植物技术[ J],中国农业科学,1988,21(3):1-6
[2]李志亮、吴忠义、杨清、等,花粉管通道法在玉米基因工程改良中的应用,玉米科学2010,18(4):71-73,76
[3]王世伟、姜丽娟、李旭业,外源DNA经花粉管通道法导入玉米及后代分子验证研究进展,高师理科学刊,2010,30(2):76-80
[4]孟宪玉、单长建、王乾坤、等,玉米花粉管通道法转化脱水素BDN1 基因,玉米科学,2014,22(6):32-35
[5]高树仁、王霞、孙丽芳、等,玉米导入碱蓬DNA后代主要农艺性状和品质性状的变异分析,黑龙江八一农垦大学学报,2016,28(5):9-13
[6]董春林、张明义、林忠平、等,用花粉管通道法将抗旱耐盐基因导入玉米自交系的研究,山西农业科学,2011,39(5):392- 394
[7]贾影影、刘凤楼、王掌军、等,大豆DNA导入春小麦后的农艺性状品质性状分析及RAPD标记验证,麦类作物学报,2016,36(7):833-840
[8]郭向萌、周晓君,花粉管通道法介导辣椒总DNA获得转基因小麦,2018,46( 8) : 36-38
[9]周岩、游建、魏琦超、等,花粉管通道法转基因对小麦主要农艺性状的影响,河南科技学院学报,2011,39(4):5-8
[10]宋笑明、谷运红、洪爱俊、等,授粉方式对小麦花粉管通道转化效果的研究,郑州大学学报( 理学版),2009,41(1):120-124
[11]欧巧明、崔文娟、王 炜、等,花粉管通道法导入高粱DNA创造优良小麦新品系的分子聚合育种,干旱地区农业研究,2013,31(2):6-12,22
[12]刘传雪、潘国君、冯雅舒、等,应用花粉管通道技术选育超级稻龙粳14试验研究,北方水稻,2009,39(1):14-17,27
[13]罗洪发、杨正林、钟秉强、等,外源DNA导入水稻后代变异性的SSR分析,中国农学通报,2005,21(7):28-30,381
[14]王志才、廖茂森、木合热皮亚·艾尔肯、等,盐穗木耐盐基因通过花粉管通道法对棉花遗传转化的研究,分子植物育种,2011, 9(2):180-184
[15]李雪、安胜军、邵铁梅、等,芝麻花粉管介导胰岛素基因的遗传转化,江苏农业学报, 2016, 32( 5) : 1013-1017
[16]刘栋、郭娜、马建富、等,外源野生胡麻总DNA 遗传转化栽培胡麻及RAPD分子验证,华北农学报·20 18,33 ( 增刊) : 29 -3 2
[17]杜人杰、曲跃军、金虎、等,水曲柳DNA浓度及滴加时间对杨树花粉管通道法结实率的影响,安徽农业科学,2014,42(22):7323-7324,7326
[18]张辉、王文月、段玉清、等,我国功能食品创新发展趋势、重点及政策建议,食品工业科技,2015,36(8):361-364
[19]向敏、黄鹤春,功能性稻米研究进展,湖北农业科学,2016,55(12):2997-3000
[20]刘仲华、李来平、曾海燕、等,国内外功能性稻米研究进展,广东微量元素科学 ,2010,17(12):13-19
[21]尤玲玲、刘金福、王媛、等,苦瓜皂苷的纯化及降血糖活性的研究,食品研究与开发,2015,36(17):32-35
[22]柴瑞华、肖春莹、关健、等,苦瓜总皂苷降血糖作用的研究,中草药,2008,39(5):746-747,751
[23]靳晓明、尤玲玲、冯超、等,苦瓜皂苷提取物微胶囊化缓释性能及体外对糖苷酶活性影响研究,食品工业科技,2014,35(16):145-148
[24]何庆峰、刘金福、尤玲玲、等,等配比苦瓜多糖与皂苷调理高血糖的联合作用研究,食品研究与开发,2010,31(9):184-187
[25]何庆峰、刘金福,尤玲玲,等,苦瓜多糖与皂苷对高血糖协同预防作用机制研究,食品与机械,2010,26(5):91-94
[26]张雅琴、李小宁、吴萍萍、等,苦瓜皂苷对糖尿病肾病PI3K/Akt信号通路的影响,江苏医药,2015,41(7):750-753
[27]尤玲玲、陈永慧、刘金福、等,苦瓜皂苷对胰岛素抵抗HepG2细胞葡萄糖消耗量的影响,食品工业科技,2014,35(5):338-345
[28]杨志刚、沈宗根、张燕萍,苦瓜皂苷对成骨细胞增殖和ALP的影响,食品科学,2010, 31(23): 383-385
[29]王步江、王瑞、张平平、等,苦瓜皂苷的制备及体外抗氧化活性研究,中国食品添加剂,2011,153-157
[30]曹亚军、杨光、李丽燕,苦瓜皂苷对亚急性衰老小鼠抗氧化作用的研究,中国老年学杂志,2007,27:947-948
[31]刘波、翟玉荣、丁汀汀、等,苦瓜皂苷改善非酒精性脂肪肝大鼠中氧化应激的作用研究,中药药理与临床,2017,33( 4):49-52
[32]尤玲玲,武毅,何庆峰,等,苦瓜皂苷对人乳腺癌MCF-7细胞增殖作用的影响,时珍国医国药,2013,24(2 ):358-360
[33]闫双勇、苏京平、王胜军、等,一 种 同时适用于水稻种子和叶片的简单快速 DNA提取方法,中国稻米,2011,17(5):11-13
[34]AOAC. Official methods of analysis (15th ed.) [S]. Arlington, 1990, VA: AOAC International
[35]张中伟、谢明勇、王远兴、等,比色法测定苦瓜总皂苷,南昌大学学报(理科版),2005,29(5):447-449,453
[36]Tang HJ, Kawamura Y, Mitsunaga T. Relationship between functionality and structure in barley starches[J]. Carbohydrate Polymer, 2004, 57: 145-152
[37]赵春芳、岳红亮、黄双杰、等,南粳系列水稻品种的食味品质与稻米理化特性,中国农业科学,2019,52(5):909-920
[38]范华、苏钰亭、刘友明、等,不同品种稻米的化学成分和理化特性研究,粮食与饲料工业,2014,3:1-5
[39]张美、杨登想、张丛兰、等,不同品种大米营养成分测定及主成分分析,食品科学,2014,39(8):147-152。
